特集細胞医薬を創り出す

再生医療をイノベーションする
実現のキーとなるプラズマ技術とマイクロデバイス技術の融合
「プラズマ」という言葉を聞いたことがあっても、プラズマとは何かを説明できる人は多くないのではないでしょうか。プラズマとは固体・液体・気体に継ぐ第4の物質の状態のこと。ガス中の分子が陽イオンと電子に分かれて運動している状態を指します。近年、さまざまな分野で応用されるなど、未来に向けて最も期待される技術の一つ。現在、熊谷慎也教授らのチームが研究を進めているテーマは、プラズマ科学・マイクロデバイス融合技術の医療分野への応用。この技術が確立されれば「医薬」として用いる細胞を自在に創り出せるようになり、医療分野の大きな革新へとつながります。

理工学部電気電子工学科
電子生命情報研究室
熊谷 慎也 教授
Shinya Kumagai
東北大学大学院工学研究科博士課程修了。松下電器産業(現 パナソニックホールディングス)株式会社先端技術研究所博士研究員などを経て、2008年~2018年、豊田工業大学准教授。2018年より本学理工学部教授。
複合領域から生まれたテーマ
プラズマで細胞を制御する
プラズマを生体に当てると、さまざまな効果があることは以前から知られていました。例えばドイツではプラズマで皮膚疾患が治るという研究や、アメリカではシワが改善したという研究が報告されています。今日、日本でもプラズマでがん細胞を死滅させる研究など、医療とプラズマの融合は今最も注目されているテーマの一つです。
プラズマが生体に影響を与えることは、実は多くの日本人が知っています。雷が落ちた時に発光する「稲妻」とは、実はプラズマのこと。昔から落雷した場所はなぜか稲の生育が良いとされ、そこから「稲妻」の名前がつけられたのは有名な話。ところが、実際にプラズマが生体細胞にどのように作用しているかはまだ解明されていません。その謎を解き明かし、プラズマによって細胞を自由にコントロールする技術を確立すること。それが私たちのゴールです。
原点となったプラズマ・MEMS・バイオ
私たちの研究について述べる前に、私の経歴についてお話しします。私は大学院で機械電子工学を専攻しましたが、さまざまな分野との「融合領域」に興味があり、半導体の微細加工を研究テーマに。そこでプラズマに出会います。幸運なことに、その研究室ではMEMS(Micro Electro Mechanical Systems:微小電気機械システム、いわゆるマイクロマシンのこと)も扱っており、私はここでプラズマとMEMSの両方を学ぶことができました。その後、民間企業の研究所で国家プロジェクトに関わり、生体超分子(たんぱく質)を用いた電子デバイスの開発に従事。さまざまな分野での研究活動を経て、「プラズマ」、「MEMS」、「バイオ」という三つの領域の知見を蓄積することができました。この経験があるから、今日の私の研究テーマがあるといっても過言ではありません。
先に述べた雷のプラズマが人に当たると大変なことになりますが、装置技術の発展で人が触れられる温度のプラズマをつくり出せるようになると、プラズマのバイオ応用研究が始まり、皮膚の疾患にプラズマを当てると治りがよくなることが報告されました。私はMEMS研究で小さいものを作っていたので、プラズマを当てる大きさを小さくしていくと何が起こるのかを考えました。細胞と同じくらいの大きさにプラズマを当てることができれば、悪性細胞だけを選択的に死滅させられるかもしれません。さらに、細胞の特定の器官を狙ってプラズマを当てることができれば、細胞を活性化させたり、不活性化させたりするなど、細胞を直接制御できるのではないかと考えたのです(図(1))。
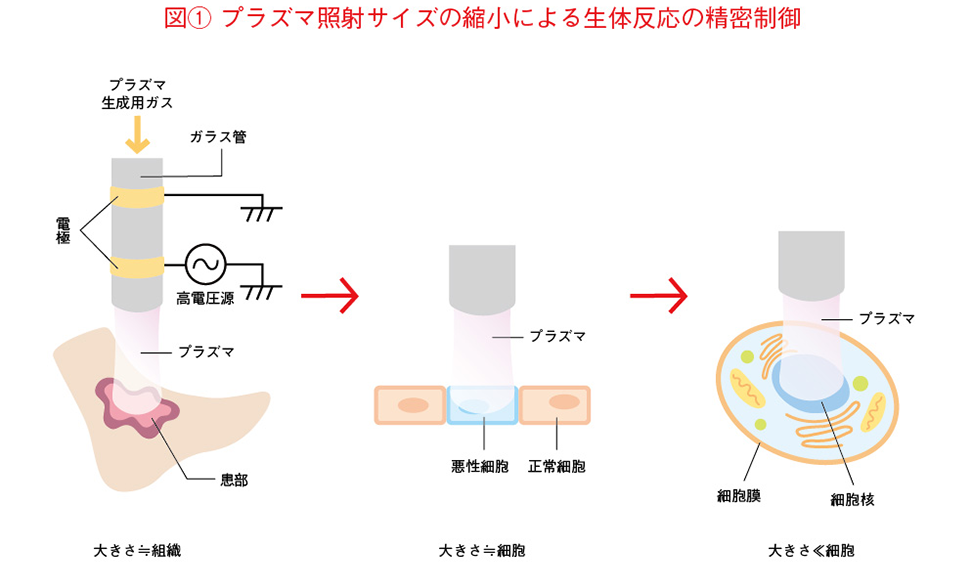
プラズマオンチップという発想
細胞をプラズマで直接刺激する
プラズマを細胞に照射した時、細胞の中でどのような変化が起きているかを解明する──。私がこのテーマで研究を始めたのは2013年でした。当時ドイツのマックスプランク研究所にいた知人から「現在の技術では、一つの細胞に確実にプラズマを照射することは難しい」という話を聞き、それなら私がやってみようと思ったのです。
通常、生体細胞にプラズマを照射するには、液体培地を用いて細胞を培養しているシャーレに外部からプラズマを当て、反応を評価するという方法が一般的でした。しかしこの方法では細胞に到達するプラズマが液体培地と衝突しながら進むため、液体培地とプラズマの間でどのような作用が起きているか、またどれだけのプラズマが到達しているかを評価するのが困難でした。それなら細胞を取り出して直接照射すれば良いのですが、そうなると細胞が乾燥してしまい、細胞の変化がプラズマによるものか乾燥によるものかの判断が難しくなります。つまり、シャーレの中にある細胞に対して、ダイレクトにプラズマを照射するという、ある意味、矛盾ともいえるような課題を克服する実験方法が必要になったのです。
表面張力を利用する
それを解決したのが、「プラズマオンチップ」というアイデアです。これは1辺が100μm(ミクロン:1μmは1000分の1mm)、深さが200μmのマイクロシャーレに、細胞が入った液体培地を入れ、底部に空けられた直径10μmの貫通孔からプラズマを照射するという方法(図(2))。夏にそうめんの水をざるで切った時、ざるの目についた水がなかなか落ちないことがありますよね。これは水の表面張力のせいですが、それと同じでマイクロシャーレの10μmの貫通孔から液体培地が漏れることはありませんし、細胞の大きさは20~30μmですから、孔から落ちることもありません。このマイクロシャーレの下でプラズマを発生させることにより、液体培地の界面から内側の細胞にダイレクトにプラズマを照射することが可能になりました。実はこの方法、私がかつてMEMSの開発で得たシリコンウェハに微細加工するノウハウをそのまま生かしたもの。私たちはこの方法を「プラズマオンチップ」と名付けました。そしてこの「プラズマオンチップ法」を発表したところ、2018年に第40回応用物理学会優秀論文賞を受賞することができました。
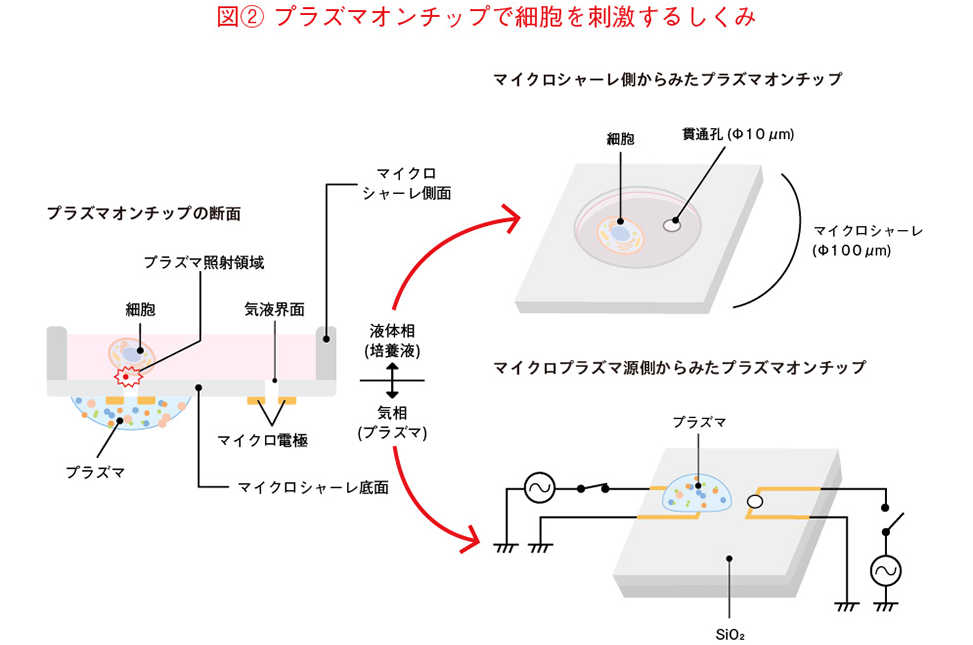
プラズマの作用を直接観察する
プラズマオンチップ法によって、プラズマが細胞に作用する様子をダイレクトに観察できるようになりました。例えば植物細胞であるクロレラにプラズマを照射すると、照射前に比べて赤い輝点が少なくなりました。これは細胞内のクロロフィルが活性を失ったことを示しています。またマウス線維芽細胞L929の実験では、プラズマを照射した後に細胞から出ていた糸状仮足が失われていることが確かめられました。こうして、プラズマが植物性・動物性細胞どちらに対しても作用を及ぼしていることが実験によって明らかになったのです。
一つの細胞にプラズマを照射する
しかしこの方法では、貫通孔と細胞に距離ができる可能性は排除できませんし、プラズマが複数の細胞に照射される可能性もありました。そこで次に考えたのは、「一つの細胞に、確実にプラズマを照射する」ための改良です。ここで私が注目したのは「結晶異方性エッチング」という技術でした。(図(3))これはシリコン基板をある条件下で腐食させるとV字型の立体構造を形成できるという技術。これもMEMSの開発中に獲得した知見の一つです。この微細加工法を用いることで、シリコン基板を逆ピラミッド状に加工して漏斗(ろうと)のようにすると、底部の貫通孔に向かって誘導にすることが可能になります。この漏斗に落ち込んだ細胞に下からプラズマを照射することで、一つの細胞に確実に照射するという仕組みが実現したのです。今日、さまざまな研究機関と共同で、改良型のプラズマオンチップを用いた研究が進められています。
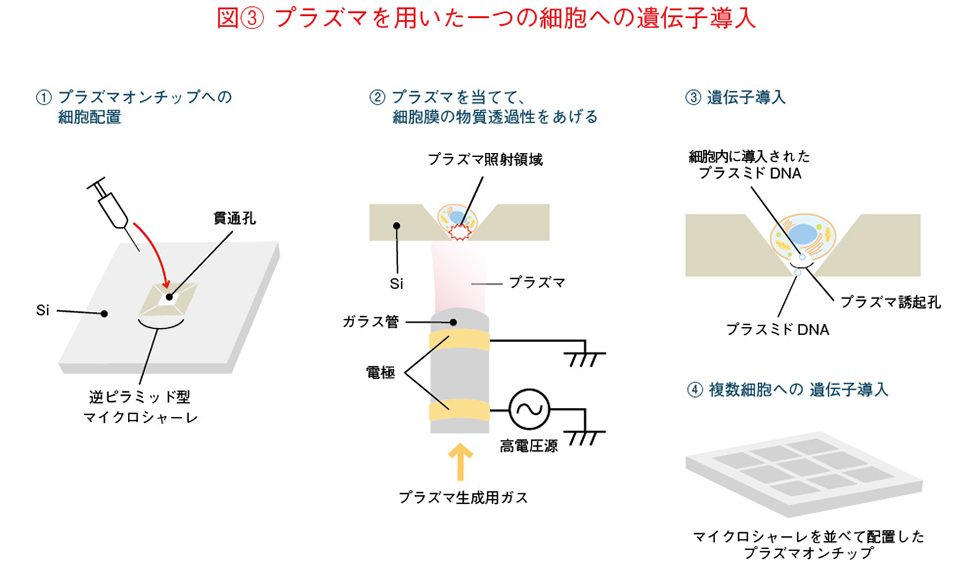
再生医療への応用展開
1億個の細胞医薬も夢ではない
ところで、プラズマを照射された細胞内ではどのような反応が起きているのでしょうか。私たちは、細胞内遺伝子に何かしらの変化が起きていると考えました。そこで、マウス筋芽細胞C2C12にプラズマを照射して、筋繊維への分化が促進されるかを研究し、さらに、共同研究者とヒトiPS細胞へのプラズマ照射実験にも着手しています。ヒトiPS細胞は、試薬で刺激を与えることで、心筋や神経といった細胞に分化する万能細胞のこと。先端医療の分野で非常に注目されています。そして今、私たちが目指しているのは、プラズマオンチップを用いて、プラズマによる刺激でヒトiPS細胞に刺激を与え、分化をコントロールする技術の確立。再生医療に使用する心筋細胞のシートを作るには、1億~10億個の細胞が必要になるといわれますが、これまでの技術では、多くの時間と労力がかかっていました。しかしプラズマオンチップを縦横に1万個ずつ並べれば、1億個の細胞を用意することは夢ではありません。これは、「プラズマ」、「MEMS」、「バイオ」という三つの領域からアプローチする私たちにしかできない取り組みだと自負しています。そして遠くない将来、私たちのプラズマオンチップで細胞を自由にコントロールする──、プラズマ刺激でヒトの体細胞から目的とする生体細胞を直接作製する「ダイレクトリプログラミング」で、必要な細胞を自由自在に創り出す技術が実現できると期待しています。








